不断出现的细菌耐药性正使得传统抗菌药物逐渐失效,由超级细菌引起的感染已经严重威胁到人类安全,探索和开发新型抗菌药物变得日趋重要。与常见的直接靶向细菌的药物不同,宿主导向抗菌化合物旨在通过提升免疫细胞功能或介入病原体与细胞间的相互作用来抑制感染并杀死细菌。从人工合成分子中筛选新型药物可以有效弥补天然分子库的耗竭。近年来的研究发现,聚集诱导发光分子(AIEgens)具有各式各样生物活性,其在医学诊疗领域已经展现出了巨大的潜力。然而,基于优秀的光动力及光热性能,这些分子在调节抗菌免疫功能上的研究却仍处于起步阶段。
近日,深圳大学材料学院王东教授团队在国际化学顶级期刊《Angewandte Chemie International Edition》(影响因子15.336,中科院JCR 1区,TOP期刊)上发表了题为《Double-pronged Antimicrobial Agents based on a Donor-π-Acceptor Type Aggregation-Induced Emission Luminogen》的研究论文。本研究从病原菌自身及其与宿主巨噬细胞相互作用时的特点出发,开发了一种同时携带阳离子,亲水性及疏水性基团的新型D-π-A类AIE分子TTTh。该分子不仅可以产生明亮的荧光,同时还具备极佳的光动力学性能。更为重要的是,该分子还可以迅速靶向宿主细胞溶酶体及甲氧西林耐药金黄色葡萄球菌(MRSA)。进一步的研究发现,靶向细菌的TTTh分子直接结合进而破坏了细菌细胞膜的完整性。同时,细胞膜的损伤使得TTTh作用后的病原菌更容易被巨噬细胞识别以及清除。更重要的是,与巨噬细胞溶酶体结合的TTTh在特定浓度下增强了溶酶体的酸化,水解酶Cathepsin D(CTSD)的表达及成熟,这最终加速了胞内病原菌的清除。最后,基于小鼠伤口感染模型的动物实验结果表明,TTTh治疗组的伤口不仅可以更快愈合,伤口区域的细菌载量也大幅减少了99%以上。此外,治疗后没有观察到组间小鼠体重变化出现差异,这也揭示了TTTh较高的生物安全性。
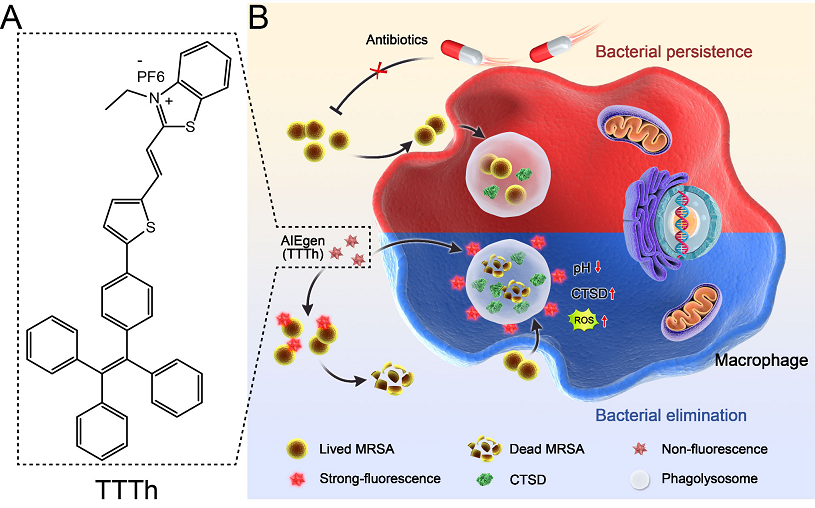
图1 新型AIE抗菌分子TTTh及其双管齐下抗菌机制示意图
该团队博士后吴逸璠和李建高为论文共同第一作者,深圳大学王东教授、广州医科大学李莹教授和香港中文大学(深圳)唐本忠院士为论文共同通讯作者,深圳大学为第一作者单位和第一通讯单位。
项目支持:本工作得到了国家自然科学基金、广东省杰出青年基金和深圳市自然科学基金的支持。
论文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202212386
